
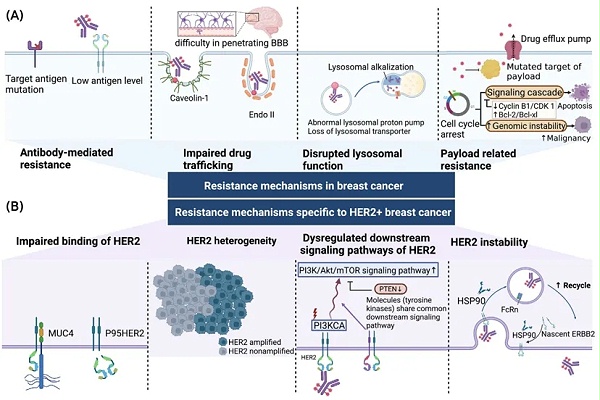
4、有效载荷(Payload )相关的耐药性

表 1 乳腺癌中 Payload 相关的耐药性 biomarker 研究
Payload相关的耐药机制及相应的生物标志物包括以下(如表1 所示):
1)一些细胞可能通过上调药物外排泵和干扰药物沉积来产生耐药性。 在不同的 T-DM1 耐药细胞系中,已经证实了多药耐药相关蛋白 1 ( MRP1 ,由 ABCC1 编码)、 MRP2 ( ABCC2 )和 MDR1 等药物外排蛋白的过度表达,并且通过分别同时使用 MRP1 、 MRP2 和 MDR1 的抑制剂可以恢复其敏感性。 在 IMMU-132 中也观察到了类似的机制。在对 IMMU-132 不敏感的乳腺癌细胞系中,已证实乳腺癌耐药蛋白( Breast Cancer Resistance Protein , BCRP ,由 ABCG2 编码) 也是一种 ATP 结合盒外排转运蛋白 的过度表达,而抑制 ABCG2 有助于克服耐药性。
2)肿瘤细胞还可以通过改变 payload 的靶点来避免细胞毒性效应。 在对 IMMU-132 耐药的 三阴性乳腺癌( Triple Negative Breast Cancer , TNBC ) 患者中发现了拓扑异构酶I ( Topoisomerase I , TOPI )的一个特定点突变,该突变被报道可诱导对临床 TOPI抑制剂的耐药性。 同源重组修复( Homologous Recombination Repair , HRR )途径的功能也与 IMMU-132 耐药性相关。
1、预测性生物标志物研究

表 2 临床前动物模型生物标志物的疗效预测研究
2、耐药性生物标志物研究

表 3 临床前耐药细胞系模型的生物标志物研究及联合用药指导
目前, ADC药物在多种肿瘤类型的治疗中表现出比传统化疗更好的疗效,但耐药性仍然是不可避免的挑战。生物标志物在 ADC药物的研发和临床应用中扮演着至关重要的角色。选择合适的生物标志物有助于提高 ADC药物的靶向性和疗效 /耐药性的预测,从而为患者提供更多、更好的治疗选择,实现个性化治疗。
[1] Chen YF, Xu YY, Shao ZM, et al. Resistance to antibody-drug conjugates in breast cancer: mechanisms and solutions. Cancer Commun (Lond). 2023;43(3):297-337.
[2] Agarwal S, Fang L, McGowen K , et al. Tumor-derived biomarkers predict efficacy of B7H3 antibody-drug conjugate treatment in metastatic prostate cancer models. J Clin Invest. 2023;133(22):e162148.
[3] Przybyla A, Rane C, Patel G , et al. Abstract LB227: Leveraging novel Dato-DXd resistance models to inform biomarker discovery and rational combinations to combat drug resistance. Cancer Res.2023; 83(8 Supplement): LB227.