
生物标志物(Biomarker)通常是指能被客观测量和评价,反映生理或病理过程,以及对暴露或治疗干预措施产生生物学效应的指标。生物标志物多来源于人体组织或体液,可涵盖生理、生化、免疫 、细胞和分子等水平的改变。生物标志物的检测可广泛地应用与病人的筛查、诊断、临床研究、指导用药、预后等领域【1】 。
根据功能特点的不同,可将与药物研发相关的生物标志物分为以下六种类型【1,2】 :
1. 诊断性生物标志物( Diagnostic Biomarker): 用于检测或确认疾病状态,或识别不同疾病亚型的生物标志物为诊断性生物标志物。诊断性生物标志物是临床疾病诊断的重要依据之一,通常作为临床试验特定受试者的入选标准。
2. 预后性生物标志物( Prognostic Biomarker): 反映疾病预后特征、疾病复发或进展风险的生物标志物为预后性生物标志物。预后性生物标志物通常作为临床试验的富集因子或分层因子。
3. 预测性生物标志物( Predictive Biomarker): 用于预测患者对某种治疗或干预措施可能产生疗效应答的生物标志物为预测性生物标志物。预测性生物标志物是目前抗肿瘤药物研发中应用最为广泛的生物标志物,可作为临床试验的富集因子或分层因子。通过采用预测性生物标志物的富集研究设计,可精准筛选出潜在获益的患者人群开展临床试验。
4. 药效学生物标志物( Pharmacodynamic/Response Biomarker): 反映患者在接受治疗后产生生物学应答的生物标志物为药效学生物标志物。药效学生物标志物是一种动态评价指标,可以是因治疗而新产生的特异性生物标志物,也可以是因治疗导致水平发生变化的已有生物指标。
5. 安全性生物标志物( Safety Biomarker): 通过用药前检测或用药过程中监测从而避免或减低患者发生严重安全性风险的生物标志物为安全性生物标志物。安全性生物标志物可帮助识别可能发生严重不良反应的患者人群 。
6. 监测性生物标志物( Monitoring Biomarker): 用于监测疾病状态变化的(如复发等)生物标志物为监测性生物标志物。
2018年1 2月,美国食品药品监督管理局(Food and Drug Administration , FDA)发布了《 Biomarker Qualification: Evidentiary Framework (D raft G uidance)》,用于指导药物研发及伴随诊断试剂研发企业研究生物标志物,图1展示了生物标志物认证流程:
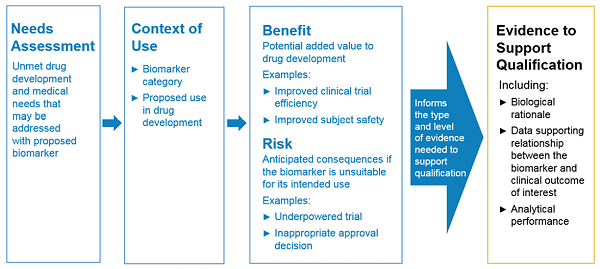
图1. 基于证据的框架( Evidentiary Framework)【3】
1. 需求评估(Needs Assessment ):研究者必须说明,现有生物标志物无法满足的新药开发项目,新生物标志物是如何加快药物开发进展及提高开发成功率的。
2. 应用场景(Context of Use ,COU) :研究者必须确定新生物标志物分类及其在药物开发过程中的应用策略。
3. 风险收益评估(Assessment of Benefits and Risks ):研究者必须评估将新生物标志物应用于药物开发的风险及收益。
4. 确定支持生物标志物认证的科学研究证据(Determining Evidence That Is Scientifically Sufficient To Support COU ):研究者必须提供足够的科学研究证据,包括新生物标志物的生物学原理( Biological Rationale)、分析验证(Analytical Validation) 、临床验证(Clinical Validation)结果等,用来证明将新生物标志物应用在药物开发过程中的科学性。图2展示了生物标志物分析验证及临床验证流程:
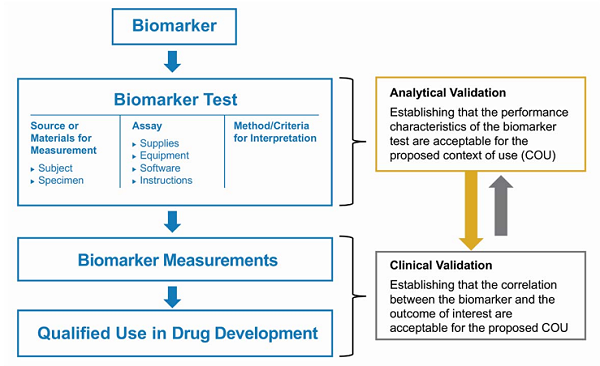
图2. 生物标志物验证方法( Biomarker Validation Approach)【3】
如表1所示,FDA对有认证潜力的生物标志物进行了评估:

表1. FDA评估具有认证潜力的生物标志物( FDA Survey to Identify Potential Biomarkers for Qualification【5】 )
生物标志物在抗肿瘤新药研发中发挥了十分重要的作用,已经有多个抗肿瘤药物因生物标志物的合理应用提高了临床研发效率,更增加了在抗肿瘤药物研发中应用生物标志物的信心【1】 。图3 展示了生物标志物研究及伴随诊断试剂开发贯穿整个药物开发生命周期:
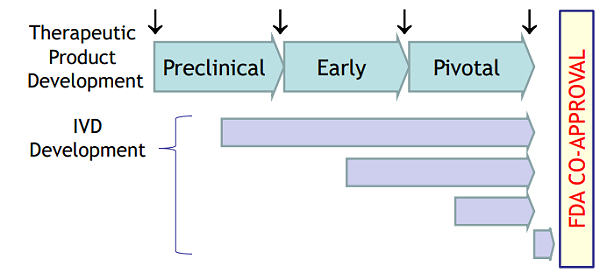
图3. 生物标志物研究及诊断试剂开发贯穿整个药物开发生命周期( Biomarker discovery (↓) and test development can occur at any point during the therapeutic product development process)【4】
越来越多的药物临床试验应用生物标志物来进行入组筛选或患者分层,图4展示了基于生物标志物设计的药物临床试验研究策略:
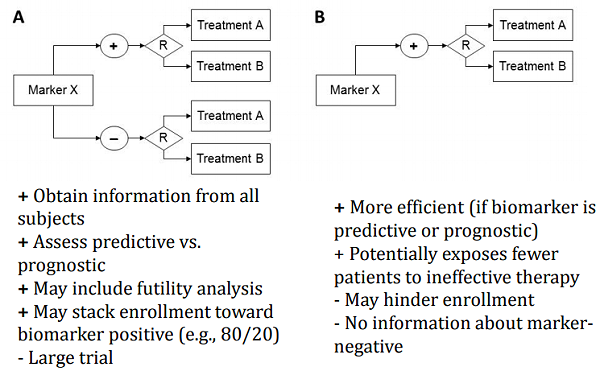
图4. 基于生物标志物设计的药物临床试验研究( Biomarker Based Clinical Trial Designs)【4】
迈杰转化医学作为国内精准诊断整体解决方案的领导者,致力于解决精准医疗药物研发及患者用药痛点,围绕生物标志物研究、伴随诊断开发,建立了完善的核酸组学、蛋白组学、细胞组学技术平台。为创新药企开展全球多中心临床试验研究,提供中心实验室检测及伴随诊断开发服务,同时解决伴随诊断全球开发面临的问题。
参考文献:
1. 国家药品监督管理局药品审评中心,生物标志物在抗肿瘤药物临床研发中应用的技术指导原则 (征求意见稿),2021年6月.
2. FDA-NIH Biomarker Working Group,BEST (Biomarkers, EndpointS, and other Tools) Resource ,Last Updated: December 28, 2020.
3. Food and Drug Administration,Biomarker Qualification: Evidentiary Framework Guidance for Industry and FDA Staff DRAFT GUIDANCE ,December 2018.
4. CDRH Learn,Principles for Codevelopment of an In Vitro Companion Diagnostic Device with a Therapeutic Product ,PowerPoint Presentation (fda.gov) .
5. Food and Drug Administration, FDA Survey to Identify Potential Biomarkers for Qualification .