
PD-L1(Programmed Death-Ligand 1,程序性细胞死亡配体 1)是目前应用广泛的评估肿瘤免疫治疗疗效的生物之一。肿瘤细胞的 PD-L1 通过与 T 细胞的 PD-1 (Programmed Death 1, 程序性死亡受体 1) 结合,产生抑制性信号、抑制 T 细胞的活化和增殖。免疫检查点抑制剂则通过阻断肿瘤细胞和T细胞的结合,克服患者自身免疫抑制, 重新激活自身免疫细胞以杀伤肿瘤,如下图所示:

通过检测肿瘤细胞中的PD-L1表达水平,可以在一定程度上预测PD-1/PD-L1抑制剂的疗效,迈杰转化医学在LeicaBond MAX平台上白主研发了PD-L1 IHC检测试剂盒(迈谱康),用来评估肿瘤细胞中PD-L1蛋白的表达水平。
国械注准20223401300
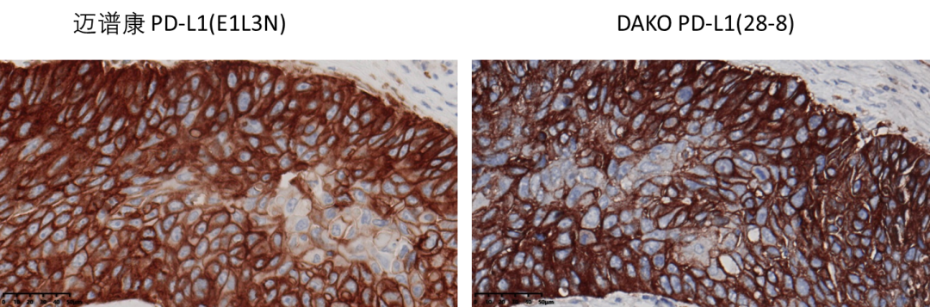
迈谱康作为NMPA批准的III类PD-L1伴随诊断试剂盒,在复旦大学附属肿瘤医院、浙江省肿瘤医院、中日友好医院、上海市胸科医院四家大型权威临床研究中心进行了超过1000例非小细胞肺癌患者样本的临床比较研究。 结果显示,迈谱康(克隆号:E1L3N)与进口PD-L1检测试剂盒(克隆号:28-8) 检测结果阳性符合率为 96.58%,阴性符合率为 98.31%,总符合率为97.77%,显示出卓越的性能。
同时迈杰医学也在复旦大学附属肿瘤医院、浙江省肿瘤医院、上海市胸科医院三家临床研究中心开展了迈谱康的观察性药效学评价临床试验,研究结果表明,PD-L1表达阳性组(TC≥1%)的患者在接受纳武利尤单抗注射液单药治疗后的总生存期(OS)改善优于 PD-L1 表达阴性组(TC<1%)的患者(p<0.05);客观缓解率(ORR)角度,PD-L1 表达阳性组(TC≥1%)的患者显著优于 PD-L1 表达阴性组(TC<1%)的患者;对迈谱康(克隆号:E1L3N) PD-L1 表达阳性组(TC≥1%)患者做进一步分析,与进口PD-L1检测试剂盒(克隆号:28-8)检测结果相比, 两组患者的总生存期改善和客观缓解率高度一致。
迈谱康作为非小细胞肺癌的伴随诊断试剂,以Leica全自动免疫组化染色机为标准适配平台。同时,结合临床实际应用需求,迈杰医学积极开展了更多适应症的扩展验证,结果显示性能优异。 迈谱康分别在三个癌种中与获批的进口试剂(克隆号22C3,Dako)进行了一致性比较,结果显示头颈鳞癌总符合率为97.6%,胃癌总符合率为95.3%,食管鳞癌总符合率为95.0%。

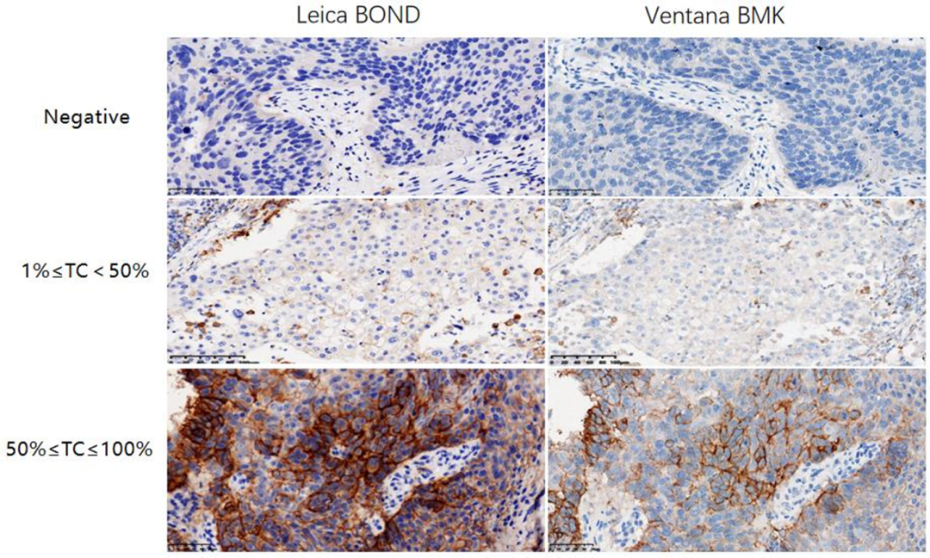
不同平台的染色一致性对比研究表明,迈谱康在Ventana(Roche)BMK全自动免疫组化染色机平台与Leica BOND全自动免疫组化染色机上染色一致性总符合率为94.59%, 表明本产品适用性强,可灵活运用于多种检测平台,满足更多科研需求 。

辅助鉴别可使用OPDIVO* (欧狄沃)治疗的NSCLC患者。

与国外有名抗体公司CST合作。

严格按照IS013485标准规定建立质量体系。

每-轮样本检测均同时设置阴、阳性组织质控片或细胞质控片进行质控。
 创新诊断产品研发
创新诊断产品研发
● 迈杰转化医学的管理和技术研发团队,博士比例高于20%。
● 全组学平台专注药物伴随诊断研发及商业化,涵盖靶向治疗、免疫治疗和细胞治疗等产品。
● 已有多个诊断产品上市,多款产品进入临床试验阶段,同时还有多个肿瘤新药伴随诊断 产品进入研发管线。
 高标准质量体系
高标准质量体系
● 建立了覆盖全平台的产品研发实验室和质检实验室。
● 按照GMP和ISO 13485的要求建立覆盖全平台产品生产的生产车间。
● 研发实验室和生产车间已获的欧盟ISO 13485 认证证书,满足IVD/CDx产品设计 生产要求,通过NMPA 质量体系考核。